Konfigurasi Elektron dan Diagram Orbital – Assalamualaikum siswa onlineku, di edisi kesempatan ini kita akan membahas materi pelajaran Kimia di kelas 10 SMA mengenai Konfigurasi Elektron dan bentuk diagram orbitalnya. Pada materi awalnya kalian telah
pelajari mengenai atom dan struktur atom serta bilangan kuantum. Dalam pelajaran kimia semua materi sama-sama terkait keduanya hingga untuk adik-adik semua sangat penting agar semakin konsentrasi saat mendalami semua dasar materi di kelas 10 ini.
Niels Bohr sebagai orang yang pertama kalinya ajukan kalau periodisitas pada sifat-sifat elemen kimia bisa diterangkan oleh susunan elektronik atom itu. Pengajuannya didasari pada bentuk atom Bohr, yang mana kelopak-kelopak elektronnya sebagai orbit dalam jarak yang tetap dari inti atom. Pembahasan materi secara lengkap baca sampai habis

Pembahasan Materi Konfigurasi Elektron dan Diagram Orbital
Pemahaman Konfigurasi Elektron
konfigurasi elektron adalah formasi dari elektron-elektron dalam sebuah atom, molekul, dan susunan fisik lainnya.Sama seperti partikel elementer, elektron runduk pada hukum mekanika kuantum dan tampilkan sifat-sifat bak-partikel atau bak-gelombang.
Secara resmi, keadaan kuantum elektron tertentu dikuasai oleh fungsi gelombangnya, yakni sebuah peranan ruangan dan saat yang berharga kompleks. Menurut interpretasi mekanika kuantum Copenhagen, status sebuah elektron tidak dapat ditetapkan terkecuali sesudah ada tindakan pengukuran yang mengakibatkan untuk dapat dideteksi.
Konfigurasi elektron sebagai langkah pengaturan elektron pada suatu atom. Langkah tentukan konfigurasi elektron dipisah jadi dua, yaitu berdasar jumlah elektron dalam tiap kulit (langkah K, L, M, N) untuk kelompok IA-VIIIA. Selanjutnya, konfigurasi elektron berdasar jumlah elektron dalam subkulit (langkah s, p, d, f). Agar bisa menuliskan, ada banyak ketentuan yang diputuskan dalam penulisan komposisi elektron.
Langkah Menentukan Konfigurasi Elektron
Aturan Aufbau
Elektron mendiami orbital dengan bertahap diawali dari yang tambah energi paling rendah. Sesudah orbital berenergi rendah berisi penuh, elektron menempati orbital yang energinya satu tingkat semakin tinggi dan sebagainya sampai semua elektron dalam atom menempati orbitalnya.
Misalnya, nomor atom hidrogen = 1. Memiliki arti sebuah elektron diisikan pada subtingkat energi 1s. Notasi penulisan ialah seperti berikut
1H = 1S1 1
Keterangan:
1: bilangan kuantum utama
S: notasi sub tingkat energi
1 pangkat: jumlah elektron yang diisikan
Aturan Hund
Orbital-orbital satu tingkat yang tempati subtingkat energi yang serupa akan berisi elektron satu-satu dengan spin yang sama arah ditambah dulu. Sesudah semua orbital satu tingkat berisi rata dengan spin yang sama arah, selanjutnya elektron selanjutnya isi orbital sebagai pasangannya dengan spin yang lain
Larangan Pauli
Tidak ada dua elektron dalam atom yang serupa mempunyai ke-4 harga bilangan kuantumnya sama.
Diagram Orbital
Baiklah adik-adik, kita akan membuat konfigurasi elektron memakai diagram orbital. Sebetulnya langkah menggambarnya gampang sekali kok. Satu subkulit punyai beberapa orbital. Orbital ini dilukiskan sebagai persegi yang berisi garis 1/2 panah sebagai elektron. Subkulit s punyai 1 orbital, p punyai 3 orbital, d punyai 5 orbital, dan f 14 orbital. Ada ketentuan-aturannya lho dalam menggambar grafik orbital.
Ketentuan saat membuat grafik orbital dapat kalian baca lagi di materi atas mengenai langkah tentukan komposisi elektron dimulai dari ketentuan aufbau, ketentuan larangan pauli dan hund. Baca dan ketahui kembali idenya guys.
Jika kalian telah memahami langsung lihat grafik orbitalnya seperti berikut :
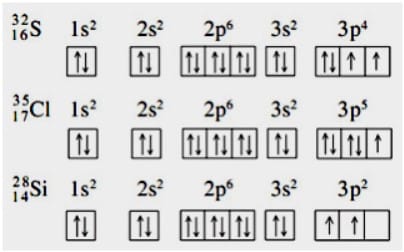
Sama dengan komposisi elektron, grafik orbital digunakan dibutuhkan untuk pelajari kenapa beberapa zat kimia memiliki warna lho. Grafik orbital dapat memvisualisasikan kenapa ada zat yang berwarna ungu, hijau, atau bahkan juga tidak warna meskipun dia sebagai logam transisi.
Misalkan pada logam peralihan yang tidak warna Zn, jika kita deskripsikan grafik orbitalnya, akan kelihatan ketidaksamaan grafik orbital di antara logam itu dengan logam peralihan warna lain.
Baik siswa online ku tersebut barusan pembahasan mengenai konfigurasi elektron dan diagram orbital. Mudah-mudahan apa yang kami berikan ini berguna untuk menambahkan pengetahuan kalian di materi pelajaran kelas 10 Semester 1 ini/ Sampai jumpa di posting selanjutnya

