Hidrolisis Garam – Garam adalah senyawa yang terbentuk dari reaksi netralisasi antara asam dan basa. Mereka umumnya terionisasi dalam air memberikan kation dan anion. Kation atau anion yang terbentuk selama ionisasi garam ada sebagai ion terhidrasi dalam larutan air atau berinteraksi dengan air untuk meregenerasi asam dan basa.
Proses interaksi antara kation atau anion garam dan air dikenal sebagai hidrolisis garam. Berdasarkan hidrolisis, garam dibagi menjadi tiga kategori yakni garam asam, garam dasar dan garam netral. Tentunya kalian semua tidak asing dengan yang namanya garam bukan.
yang untuk masakan dan rasanya asin? tapi tunggu dulu gais bukan garam dapur itu yang kita bahas kali ini melainkan garam dalam kimia. Mau tahu ulasannya langsung kalian baca artikelnya sampai habis dan pahami konsep materinya yah.

Deskripsi Tentang Hidrolisis Garam
Memanggang tampaknya mudah dengan semua item pra-campuran yang tersedia. (“cukup tambahkan air dan aduk”). Namun, ada banyak bahan kimia yang terlibat dalam memanggang dengan bahan-bahan yang diukur. Salah satu bahan penting adalah baking powder.
Kehalusan pada produk akhir dari resep non-ragi biasanya disebabkan oleh karbon dioksida yang dibentuk oleh baking powder. Salah satu merek populer menggunakan campuran natrium bikarbonat dan natrium aluminium sulfat untuk menghasilkan CO2. Reaksinya adalah:
3NaHCO3+NaAl(SO4)2→Al(OH)3+2Na2SO4+3CO2
Garam dari asam kuat dan basa kuat : Garam yang dibentuk oleh netralisasi asam kuat dan basa kuat bersifat netral karena ikatan dalam larutan garam tidak akan pecah. Mereka umumnya terhidrasi tetapi tidak menghidrolisis. Oleh karena itu, garam semacam itu umumnya dikenal sebagai garam netral.
Contoh: NaCl
Persamaan Hidrolisis Garam
Garam adalah senyawa ionik yang terbentuk ketika asam dan basa saling menetralkan. Meskipun kelihatannya larutan garam selalu netral, larutan tersebut sering bersifat asam atau basa. Pertimbangkan garam yang terbentuk ketika asam hidrofluorik asam lemah dinetralkan oleh basa kuat natrium hidroksida. Persamaan molekul dan ion bersih ditunjukkan di bawah ini.
HF(aq)+NaOH(aq)→NaF(aq)+H2O(l)HF(aq)+OH−(aq)→F−(aq)+H2O(l)
Karena natrium fluorida larut, ion natrium adalah ion penonton dalam reaksi netralisasi. Ion fluorida mampu bereaksi, untuk sebagian kecil, dengan air, menerima proton.
F−(aq)+H2O(l)⇌HF(aq)+OH−(aq)
Ion fluorida bertindak sebagai basa Brønsted-Lowry yang lemah. Ion hidroksida yang dihasilkan dari reaksi di atas membuat larutan menjadi sedikit basa. Hidrolisis garam adalah reaksi di mana salah satu ion dari garam bereaksi dengan air, membentuk larutan asam atau basa.
Garam Yang Membentuk Larutan Dasar
Ketika natrium fluorida padat dilarutkan ke dalam air, ia benar-benar terdisosiasi menjadi ion natrium dan ion fluorida. Ion natrium tidak memiliki kemampuan untuk menghidrolisis, tetapi ion fluorida menghidrolisis untuk menghasilkan sejumlah kecil asam fluorida dan ion hidroksida.
F−(aq)+H2O(l)⇌HF(aq)+OH−(aq)
Garam yang berasal dari netralisasi asam lemah (HF) oleh basa kuat (NaOH) akan selalu menghasilkan larutan garam yang bersifat basa.
Garam Yang Membentuk Larutan Asam
Amonium klorida (NH4Cl) adalah garam yang terbentuk ketika asam kuat HCl dinetralkan oleh basa lemah NH3. Amonium klorida larut dalam air. Ion klorida yang dihasilkan tidak mampu terhidrolisis karena merupakan basa konjugat dari asam kuat HCl.
Dengan kata lain, Cl− ion tidak dapat menerima proton dari air untuk membentuk HCl dan OH− , seperti yang dilakukan ion fluorida pada bagian sebelumnya. Namun, ion amonium mampu bereaksi sedikit dengan air, menyumbangkan proton dan bertindak sebagai asam.
NH+4(aq)+H2O(l)⇌H3O+(aq)+NH3(aq)
Garam Yang Membentuk Larutan Netral
Garam yang berasal dari reaksi asam kuat dengan basa kuat membentuk larutan yang memiliki pH 7. Contohnya adalah natrium klorida, yang terbentuk dari penetralan HCl oleh NaOH. Larutan NaCl dalam air tidak memiliki sifat asam atau basa, karena tidak ada ion yang mampu terhidrolisis. Garam lain yang membentuk larutan netral termasuk kalium nitrat (KNO3) dan litium bromida (LiBr).
Tabel di bawah merangkum cara menentukan keasaman atau kebasaan larutan garam.
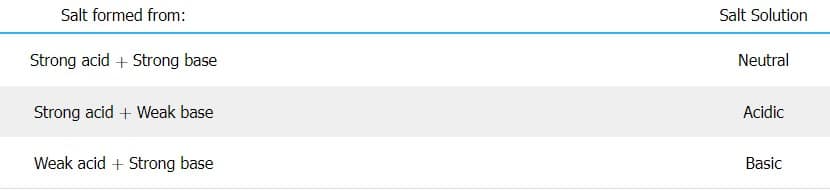
Garam yang terbentuk dari reaksi asam lemah dan basa lemah lebih sulit dianalisis karena persaingan reaksi hidrolisis antara kation dan anion. Garam-garam ini tidak dibahas dalam konsep bab ini.
Ringkasan
Hidrolisis garam adalah reaksi di mana salah satu ion dari garam bereaksi dengan air, membentuk larutan asam atau basa. Garam yang berasal dari netralisasi asam lemah oleh basa kuat akan selalu menghasilkan larutan garam yang bersifat basa.
Garam yang berasal dari netralisasi asam kuat oleh basa lemah akan selalu menghasilkan larutan garam yang bersifat asam. Garam yang berasal dari reaksi asam kuat dengan basa kuat membentuk larutan yang memiliki pH 7.

