Larutan Penyangga adalah larutan berbasis pelarut air yang terdiri dari campuran yang mengandung asam lemah dan basa konjugat dari asam lemah, atau basa lemah dan asam konjugat dari basa lemah. Mereka menolak perubahan pH pada pengenceran atau pada penambahan sejumlah kecil asam/alkali ke dalamnya.
PH Larutan Penyangga menunjukkan perubahan minimal pada penambahan sejumlah kecil asam kuat atau basa kuat. Oleh karena itu mereka digunakan untuk menjaga pH pada nilai konstan. Buat kalian yang saat ini duduk di kelas 11 SMA pada ulasan materi Larutan penyangga
kita akan mengulas dan mempelajari mulai dari pengertian, Jenis larutan penyangga dan juga fungsinya. Untuk mengetahui informasi dan ulasan materi selengkapnya kalian wajib membaca artikelnya sampai habis.

Apa itu Larutan Penyangga?
Larutan penyangga adalah larutan yang mampu mempertahankan konsentrasi ion Hidrogen (pH) dengan hanya sedikit perubahan pengenceran atau penambahan sedikit asam atau basa. Biasanya Larutan penyangga digunakan dalam fermentasi, pengawet makanan, pengiriman obat, elektroplating,
pencetakan, aktivitas enzim, kapasitas pembawa oksigen darah membutuhkan konsentrasi ion hidrogen (pH) spesifik. Larutan asam lemah dan basa konjugatnya atau basa lemah dan asam konjugatnya mampu mempertahankan pH dan merupakan larutan penyangga.
Jenis Larutan Penyangga
Dua jenis utama di mana larutan penyangga diklasifikasikan secara luas adalah penyangga asam dan basa.
Penyangga Asam
Seperti namanya, solusi ini digunakan untuk menjaga lingkungan asam. Penyangga asam memiliki pH asam dan dibuat dengan mencampurkan asam lemah dan garamnya dengan basa kuat. Larutan berair dari asam asetat dan natrium asetat dengan konsentrasi yang sama memiliki pH 4,74.
pH larutan ini di bawah tujuh
Larutan ini terdiri dari asam lemah dan garam dari asam lemah.
Contoh larutan penyangga asam adalah campuran natrium asetat dan asam asetat (pH = 4,75).
Penyangga Basa
Larutan penyangga ini digunakan untuk menjaga kondisi dasar. Penyangga basa memiliki pH basa dan dibuat dengan mencampurkan basa lemah dan garamnya dengan asam kuat. Larutan berair dari konsentrasi yang sama antara amonium hidroksida dan amonium klorida memiliki pH 9,25.
PH larutan ini di atas tujuh
Mereka mengandung basa lemah dan garam dari basa lemah.
Contoh larutan penyangga basa adalah campuran amonium hidroksida dan amonium klorida (pH = 9,25).
Mekanisme Tindakan Larutan Penyangga
Dalam larutan, garam terionisasi sempurna dan asam lemah terionisasi sebagian.
CH3COONa ⇌ Na+ + CH3COO–
CH3COOH ⇌ H+ + CH3COO–
Pada Penambahan Asam dan Basa
1. Pada penambahan asam, proton asam yang dilepaskan akan dihilangkan oleh ion asetat untuk membentuk molekul asam asetat.
H+ + CH3COO– (dari asam yang ditambahkan) ⇌ CH3COOH (dari larutan penyangga)
2. Pada penambahan basa, hidroksida yang dilepaskan oleh basa akan dihilangkan oleh ion hidrogen membentuk air.
H2O– + H+ (dari basa yang ditambahkan) ⇌ H2O (dari larutan penyangga)
Persiapan Larutan Penyangga
Jika konstanta disosiasi asam (pKa) dan basa (pKb) diketahui, larutan penyangga dapat dibuat dengan mengatur rasio garam-asam atau garam-basa. Seperti yang telah dibahas sebelumnya, larutan ini dibuat dengan mencampurkan basa lemah dengan asam konjugatnya yang sesuai, atau dengan mencampurkan asam lemah dengan basa konjugatnya yang sesuai.
Contoh metode pembuatan larutan penyangga ini dapat diberikan dengan pembuatan penyangga fosfat dengan mencampurkan HPO42- dan H2PO4-. PH yang dipertahankan oleh larutan ini adalah 7,4.
Persamaan Handerson-Hasselbalch
Persiapan Penyangga Asam
Pertimbangkan larutan penyangga asam, yang mengandung asam lemah (HA) dan garamnya (KA) dengan basa kuat (KOH). Asam lemah HA terionisasi, dan kesetimbangan dapat ditulis sebagai-
HA + H2O ⇋ H+ + A−
Konstanta disosiasi asam = Ka = [H+] [A–]/HA
Mengambil, log (-) RHS dan LHS :
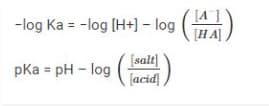
pH penyangga asam = pKa + ([garam]/[asam])
Persamaannya adalah persamaan Henderson-Hasselbalch, yang dikenal sebagai persamaan Henderson.
Persiapan Penyangga Dasar
Pertimbangkan larutan penyangga basa, yang mengandung basa lemah (B) dan garamnya (BA) dengan asam kuat.
pOH, dapat diturunkan seperti di atas,
pOH buffer basa = pKb + log ([garam]/[asam])
pH buffer basa = pKa – log ([garam]/[asam])
Signifikansi Persamaan Handerson
Persamaan Handerson dapat digunakan untuk:
Hitung pH buffer yang dibuat dari campuran garam dan asam/basa lemah.
Hitung nilai pKa.
Siapkan larutan buffer pH yang dibutuhkan.
Keterbatasan Persamaan Henderson-Hasselbalch
Persamaan Henderson – Hasselbalch tidak dapat digunakan untuk asam kuat dan basa kuat.
Kapasitas Penyangga
Jumlah milimol asam atau basa yang akan ditambahkan ke dalam satu liter larutan penyangga untuk mengubah pH sebesar satu satuan adalah kapasitas Penyangga dari penyangga tersebut.
Β = milimol /(ΔpH)
Masalah pada Buffer Solution
Soal 1 : Berapa perbandingan basa dan asam jika pH = pKa dalam larutan penyangga? Bagaimana jika pH = PKa + 1?
Sol:
pH = pKa bila perbandingan basa dan asam adalah 1 karena log 1 = 0.
Ketika log (basa/asam) = 1, maka perbandingan basa dan asam adalah 10:1.
Soal 2 : Berapakah pH larutan buffer dari 0,5 M amoniak dan 0,5 M amonium klorida jika, cukup asam klorida yang sesuai untuk membuat 0,15 M HCl?
Sol:
pKb amonia adalah 4,75.
pKa = 14 – pKb. = 9,25
0,15 M H+ bereaksi dengan 0,15 M amonia membentuk 0,15 M lebih banyak amonium.
Jadi, ion amonium adalah 0,65 M dan sisa 0,35 M amonia (basa).
Menggunakan persamaan Henderson-Hasselbalch,
pKa – log ([garam]/[asam]) = 9.25 – log (.65/.35) = 9.25 – .269 = 8.98
Soal 3 : Berapa mol natrium asetat dan asam asetat yang harus Anda gunakan untuk menyiapkan 1,00 L buffer 0,100 mol/L dengan pH 5,00.
Sol:
pH = pKa + log([A−][HA])
5,00 = 4,74 + log([A−][HA])
log([A−][HA]) = 0,26
[A−][HA]=10,26 = 1,82
[A⁻] = 1,82[HA]
Juga, [A⁻] + [HA] = 0,100 mol/L
1,82[HA] + [HA] = 0,100 mol/L
2,82[HA] = 0,100 mol/L
[HA] = 0,0355 mol/L
[A⁻] = (0,100 – 0,0355) mol/L = 0,0645 mol/L
0,0355 mol asam asetat dan 0,0645 mol natrium asetat diperlukan untuk menyiapkan 1 L larutan penyangga.
Pemeliharaan pH
Untuk memahami bagaimana larutan penyangga mempertahankan pH konstan, mari kita perhatikan contoh larutan penyangga yang mengandung natrium asetat dan asam asetat. Dalam contoh ini, dapat dicatat bahwa natrium asetat hampir sepenuhnya mengalami ionisasi sedangkan asam asetat hanya terionisasi lemah. Reaksi kesetimbangan ini dapat ditulis sebagai:
CH3COOH ⇌ H+ + CH3COO–
CH3COONa ⇌ Na+ + CH3COO–
Ketika asam kuat ditambahkan, ion H+ bergabung dengan ion CH3COO– menghasilkan asam asetat terionisasi lemah, menghasilkan perubahan pH lingkungan yang dapat diabaikan.
Ketika zat yang sangat basa dimasukkan ke dalam larutan penyangga ini, ion hidroksida bereaksi dengan asam yang bebas dalam larutan untuk menghasilkan molekul air, seperti yang ditunjukkan pada reaksi di bawah ini.
CH3COOH + OH– ⇌ CH3COO– + H2O
Oleh karena itu, ion hidroksida bereaksi dengan asam membentuk air, dan pH tetap sama.
Penggunaan Larutan Penyangga
Ada beberapa nama alternatif yang digunakan untuk menyebut larutan penyangga, seperti penyangga pH atau penyangga ion hidrogen.
Contoh penggunaan buffer dalam pengaturan pH adalah penggunaan sistem buffer bikarbonat dan asam karbonat untuk mengatur pH darah hewan.
Larutan buffer juga digunakan untuk mempertahankan pH optimum untuk aktivitas enzim pada banyak organisme.
Tidak adanya buffer ini dapat menyebabkan perlambatan aksi enzim, hilangnya sifat enzim, atau bahkan denaturasi enzim. Proses denaturasi ini bahkan dapat menonaktifkan aksi katalitik enzim secara permanen.