prakerja.co.id : di kesempatan kali ini kami akan berbagi ilmu pengetahuan seputar Faktor-Faktor Laju Reaksi khususnya bagi temen-temen yang masih duduk di bangku kelas 11 dengan materi pelajaran (KIMIA),
Nah saat pandemi seperti sekarang ini penting bagi kita untuk fokus menjaga kesehatan secara rutin ya dengan banyak berolahraga saat teman-teman berolahraga di luar rumah atau bersepeda Pernahkah teman-teman Terinjak paku pernah juga kah teman-teman memperhatikan kondisi paku di dalam rumah berbeda dengan di luar rumah ?,
biasanya paku di luar rumah lebih cepat berkarat dibandingkan dengan paku yang berada di dalam rumah kira-kira akan menyebabkan paku menjadi lebih cepat berkarat apakah karena terpapar sinar matahari atau karena diguyur hujan ?,
atau Karena suhu udara luar paku yang lebih cepat berkarat tadi merupakan proses kimia secara alami yang mengalami laju reaksi karena beberapa faktor, nah di artikel kali ini kita akan bahas lebih lengkap tentang faktor yang mempengaruhi laju reaksi, yuk ikuti terus pembahasan nya sampai selesai ya
Apa Itu Laju Reaksi ?
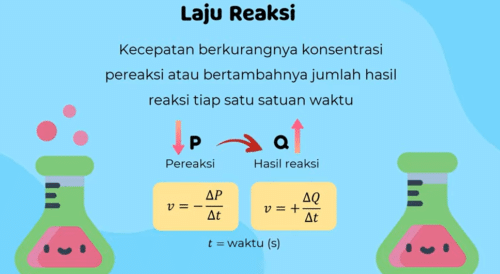
Perubahan benda yang terjadi secara kimia akan mengalami laju reaksi sebelumnya kita sudah tahu bahwa laju reaksi terjadi Dengan berkurangnya konsentrasi pereaksi atau bertambahnya jumlah hasil reaksi setiap satuan waktu jika P adalah variasi maka P akan mengalami kecepatan pengurangan konsentrasi dan jika q adalah zat hasil reaksi atau produk maka q akan mengalami kecepatan bertambahnya jumlah hasil reaksi dalam waktu tertentu
Laju reaksi ini dapat dirumuskan menjadi V = minus Delta P Delta t dan V = + Delta Q per Delta t v merupakan laju reaksi dengan satuannya molaritas per sekon dan t adalah waktu dalam sekon tanda minus menandakan zat pereaksi berkurang sedangkan Tanda plus menunjukkan produk reaksi bertambah
berikut contoh gambar rumus lajur reaksi sebagai berikut :
Faktor-Faktor Yang Mempengaruhi Lajur Reaksi
Nah teman-teman laju reaksi ini dapat dipercepat dengan beberapa faktor yaitu luas permukaan, suhu, konsentrasi dan katalis mari kita akan membahas semuanya satu persatu ya :
– Luas Permukaan
Faktor pertama luas permukaan jika kita melakukan percobaan dengan 3 gelas berisi air ketika gelas ini akan kita masukkan gula merah dengan bentuk dan ukuran yang berbeda gelas a kita masukkan gula merah utuh berbentuk balok kemudian Ayah pada gelas B juga kita campur dengan gula merah berbentuk butiran dan gelas C kita masukkan gula merah kepingan berbentuk persegi panjang
Teman-teman gula merah Manakah yang lebih cepat larut pada gelas a b atau c ternyata hasilnya gula merah berbentuk butiran pada gelas B lebih cepat larut dibandingkan gula merah ke bentuk lain.
contoh gambar luas permukaan
Jadi Bagaimanakah pengaruh ukuran kepingan zat padat terhadap laju reaksi dari percobaan tadi kita tahu bahwa semakin kecil ukuran partikel maka permukaan bidang sentuh akan semakin luas dan tumbukan yang terjadi pada bidang permukaan semakin banyak sehingga laju reaksi semakin cepat jadi semakin kecil ukuran partikel laju reaksinya akan semakin cepat.
– Suhu
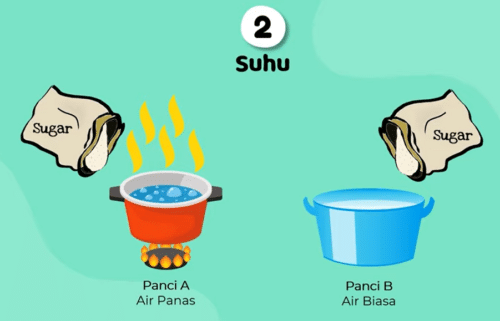
Faktor kedua yaitu suhu bisa kita amati dengan contoh berikut ini ada 2 panci A dan B berisi air yang berbeda, panci A berisi air yang dipanaskan dan panci B berisi air biasa ya, nah kedua air pada panci sama-sama kita campur kan dengan gula tadi.
Nah dengan kondisi ini menurut teman-teman gula pada panci Manakah yang lebih cepat larut ?
Jawaban nya adalah : panci A ya temen-temen, karena Gula yang kita masukkan pada panci A berisi air panas akan lebih cepat larut
contoh gambar suhu
Bagaimanakah hubungan antara suhu dengan laju reaksi suhu yang tinggi akan membuat partikel dalam larutan bergerak lebih cepat sehingga kemungkinan partikel untuk bertumbukan semakin besar dan laju reaksi akan terjadi lebih cepat jadi semakin tinggi suhu laju reaksinya akan lebih cepat
Antara suhu dengan data sebagai berikut dari data dapat kita lihat setiap kenaikan 10 derajat Celcius maka laju reaksi mengalami kenaikan sebanyak 2 kali semula ini menunjukkan suhu memiliki hubungan yang sebanding dengan laju reaksi laju reaksi akan meningkat sesuai dengan kenaikan suhunya
contoh gambar hubungan kuantitatif perubahan suhu terhadap lajur reaksi
contoh gambar : rumus kuantitatif perubahan suhu terhadap lajur reaksi
Hubungan kuantitatif perubahan suhu terhadap laju reaksi dapat dirumuskan menjadi PT = Delta v ^ a * v 0 V T adalah laju reaksi akhir Delta v adalah kenaikan laju reaksi fenol adalah laju reaksi awal satuannya dalam molalitas per sekon Delta t adalah perubahan suhu dan a adalah kenaikan suhu dengan satuan derajat Celcius.
– Konsentrasi
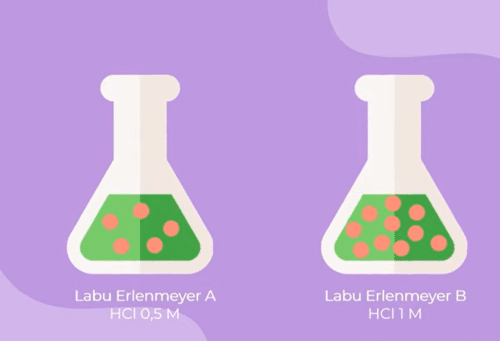
Oke teman-teman faktor ketiga yang mempengaruhi laju reaksi adalah konsentrasi untuk melihat pengaruh keduanya nabi kita perhatikan labu Erlenmeyer a dan b berikut keduanya berisi asam klorida dengan konsentrasi larutan berbeda labu Erlenmeyer a memiliki konsentrasi 0,5 molaritas sedangkan b 1 molaritas nah menurut teman-teman Manakah yang lebih cepat bereaksi antara labu Erlenmeyer a atau b
Untuk menjawabnya kita perlu ingat kembali bahwa reaksi kimia terjadi jika partikelnya saling bertumbukan semakin besar konsentrasi maka semakin banyak partikel zat yang bereaksi akibatnya kemungkinan tumbukan antar partikel akan banyak terjadi dan laju reaksi meningkat Sama halnya dengan ilustrasi berikut manakah yang lebih mungkin terjadi tabrakan di jalanan lengang atau jalanan yang padat pastinya di jalanan yang padat ya berarti lampu elemen B lebih cepat bereaksi dibandingkan a
contoh gambar konsentrasi
Jadi semakin besar konsentrasi suatu zat akan semakin pekat suatu larutan dan banyak partikel yang dikandungnya akibatnya semakin banyak kemungkinan terjadi tumbukan sehingga laju reaksi menjadi semakin cepat.
– Katalis
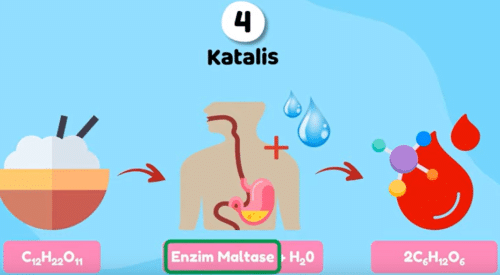
Oke teman-teman kita yang ke-4 saat kita dengan bantuan enzim maltase dan air sehingga menjadi glukosa enzim maltase inilah yang menjadi katalis pada proses pencernaan kita,
Jadi apa itu katalis katalis merupakan suatu zat yang dapat mempercepat laju reaksi kimia pada suhu tertentu tanpa mengalami perubahan atau terpakai oleh reaksi itu sendiri sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali katalis ini akan mempercepat laju reaksi dengan cara mengurangi energi aktivasi ada dua jenis katalis katalis homogen dan katalis heterogen
Katalis homogen adalah katalis berada dalam fase yang sama dengan reaktan biasanya katalis dan reaktan berada dalam satu fase tunggal berwujud cair atau gas contohnya asam sulfat natrium hidroksida kalium hidroksida sedangkan pada katalis heterogen katalis dan hartanya berada dalam fase yang berbeda,
biasanya katalis berwujud padat seperti logam nikel dan platina yang banyak digunakan dalam industri industri untuk menghemat biaya produksi katalis mempercepat laju reaksi dengan menurunkan energi aktivasi kondisi ini mengakibatkan tumbukan efektif menjadi lebih sering terjadi
contoh gambar katalis
Nah Berarti semakin banyak katalis energi aktivasi akan semakin turun dan tumbukan efektif lebih sering terjadi sehingga laju reaksi akan semakin cepat jadi katalis sebanding dengan laju reaksi sampai disini teman-teman bisa paham ya.
Demikianlah ulsasan dari kami seputar mempelajari dan memahami faktor faktor laju reaksi, semangat terus belajar nya ya temen-temen, semoga dapat bermanfaat. Terima kasih.
baca juga : sistem pertahanan tubuh pada manusia