Prakerja.Co.Id : Pada pembahasan kali ini kami akan mengulas seputar sel elektrolisis, pada mata pelajaran kimia khususnya untuk temen-temen yg masih duduk di kelas 12 ya. Nah teman-teman pasti tahu yang nama nya aki (Accu) pada mobil / motor kan !, apakah teman-teman tahu bagaimana proses pengisian ulang energi kimia, pada aki (Accu) ini menerapkan prinsip sel elektrolisis,
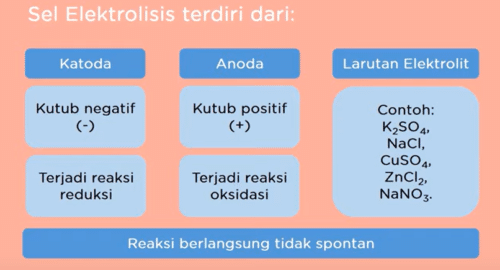
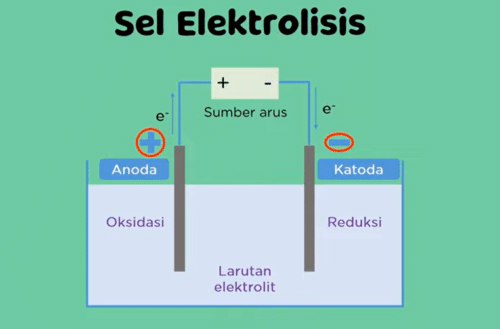
Perhatikan diagram sel elektrolisis berikut sel elektrolisis menggunakan elektroda berupa katoda dan anoda serta larutan elektrolit katoda di kutub (-) sedangkan anoda di kutub positif
pada sel elektrolisis di katoda Terjadi reaksi reduksi sedangkan di anoda Terjadi reaksi oksidasi pada proses pengubahan energi ini reaksi berlangsung tidak spontan.
Berikut catatan diagram elektrolisis :
Cara Kerja Sel Elektrolisis
Pertama katoda dihubungkan dengan kutub (-) dan anoda dihubungkan dengan kutub positif dari sumber arus listrik, kemudian sumber arus listrik memompa elektron ke katoda dan ditangkap oleh kation sehingga pada permukaan katoda terjadi reduksi pada kation,
pada saat yang sama anion melepaskan elektron sehingga terjadi reaksi oksidasi di anoda elektron yang dilepaskan menuju sumber arus listrik.
Kemudian sumber arus listrik elektron ke katoda dan ditangkap oleh kation sehingga pada permukaan katoda terjadi reduksi pada kation pada saat yang sama anion melepaskan elektron sehingga terjadi reaksi oksidasi di anoda elektron yang dilepaskan menuju sumber arus listrik.
Reaksi Elektrolisis
Pada sel elektrolisis, reaksi elektrolisis berlangsung kompleks, bisa terjadi pada kation, anion, air atau elektrodanya.
Reaksi Elektrolisis Pada Katoda :
Teman-teman sekarang kita bahas reaksi elektrolisis yang berlangsung di katoda pada katoda reaksi elektrolisis bergantung pada jenis kation yang pertama kation logam aktif yaitu golongan 1A kecuali hidrogen golongan 2A aluminium 3 + dan mangan 2 +
berwujud kelautan maka yang mengalami reduksi adalah air dengan persamaan reaksi berikut kedua kation lain dan kation logam aktif yang berwujud lelehan atau leburan maka yang mengalami reduksi adalah kation tersebut Contoh na + Liquid + elektron menghasilkan na solid.
Reaksi Elektrolisis Pada Anoda :
Selanjutnya dielektrolisis yang berlangsung di anoda pada anoda reaksi elektrolisis bergantung pada anoda dan anion anoda ada dua jenis yaitu indah dan tidak indah yaitu elektroda pada anoda tidak terlibat dalam reaksi jadi yang bereaksi pada anoda ini hanya anion saja
Pada anoda tidak indah yang mengalami oksidasi adalah a noda tersebut pertama anoda ini yang termasuk anoda adalah platina karbon dan emas anion yang bereaksi ada beberapa ketentuan yaitu anion sisa asam oksi seperti so4 2 min no3 min po4 3 min dan co3 2 min,
maka yang mengalami oksidasi adalah air dengan persamaan reaksi berikut anion sisa asam lain oh Amin atau O2 Min maka yang mengalami oksidasi adalah anion tersebut Contoh larutan 2 O2 Min menghasilkan gas oksigen dan 4 elektron selanjutnya anoda tidak inner contoh logam Cu AGB dengan persamaan reaksi berikut logam menghasilkan larutan ion CO2 + dan 2 elektron.
Oke jadi itu saja ya temen-temen, ulasan sel elektrolisis yg singkat, padat, dan cukup jelas semoga bisa di mengerti ya, semangat belajar terus dan semoga dapat bermanfaat.
baca juga : contoh faktor faktor laju reaksi dalam kehidupan sehari hari